南京中國eCTD系統(tǒng)
eCTD提交流程與ESG系統(tǒng):FDA要求通過電子提交網(wǎng)關(guān)(ESG)傳輸eCTD文件,單個(gè)文件大小限制為10GB,超限需拆分或通過物理介質(zhì)(如光盤)遞交。提交前需預(yù)分配申請(qǐng)?zhí)枺ㄈ鏝DA編號(hào)),并通過ESG測(cè)試賬戶驗(yàn)證技術(shù)合規(guī)性。序列號(hào)命名規(guī)則為4位數(shù)字(如0001),申請(qǐng)需從“原申請(qǐng)”序列開始,補(bǔ)充資料按遞增順序編號(hào)。企業(yè)可自愿提交預(yù)審樣本(Pre-Submission),F(xiàn)DA將反饋文檔結(jié)構(gòu)、元數(shù)據(jù)等合規(guī)性問題。驗(yàn)證標(biāo)準(zhǔn)與常見錯(cuò)誤類型:FDA驗(yàn)證標(biāo)準(zhǔn)分為高(High)、中(Medium)、低(Low)三級(jí),高風(fēng)險(xiǎn)錯(cuò)誤(如無效XML或缺失關(guān)鍵表格)必須修復(fù),否則直接拒收。常見問題包括:重復(fù)序列號(hào)(錯(cuò)誤1034)、文件路徑超長(zhǎng)(警告2015)、PDF加密或非標(biāo)字體(錯(cuò)誤4001)。2023年統(tǒng)計(jì)顯示,30%的提交因模塊1格式錯(cuò)誤被退回,凸顯行政信息合規(guī)的重要性。驗(yàn)證工具如LORENZ eValidator被FDA官方采用,可自動(dòng)檢測(cè)200+項(xiàng)技術(shù)指標(biāo)。澳大利亞eCTD注冊(cè)外包相關(guān)技術(shù)支持。南京中國eCTD系統(tǒng)

eCTD即是電子化的CTD注冊(cè)申報(bào)方式,相對(duì)于傳統(tǒng)的紙質(zhì)遞交,eCTD電子遞交更便捷、更安全。對(duì)于申請(qǐng)者來說,一個(gè)產(chǎn)品如在多個(gè)市場(chǎng)遞交,M2-M5的資料可以共享,極大降低了成本并提高了效率;對(duì)審評(píng)者來說,eCTD資料的審閱、管理、傳輸以及歸檔十分便捷,eCTD格式同時(shí)也利于各個(gè)地區(qū)的yao監(jiān)部門的審評(píng)意見交流。eCTD遞交自2003年開始實(shí)施以來,以其在創(chuàng)建、傳輸、復(fù)制、審閱、檢索、存檔以及文件生命周期管理等方面的優(yōu)勢(shì)當(dāng)之無愧地成為全球YAO品注冊(cè)申報(bào)的大勢(shì)所趨,除了傳統(tǒng)的美國、日本和歐盟等ICH成員國之外,加拿大、瑞士、沙特阿拉伯、南非、澳大利亞、新西蘭、泰國、新加坡、韓國等地區(qū)都已經(jīng)部分采納或者正在逐步轉(zhuǎn)向eCTD遞交。賦悅科技,做為國內(nèi)自主研發(fā)服務(wù)器版eCTDYAO品注冊(cè)申報(bào)軟件,讓法規(guī)注冊(cè)事務(wù)從系統(tǒng)上極大縮短申報(bào)周期,助力企業(yè)加快產(chǎn)品上市速度。迅速實(shí)施,上手簡(jiǎn)單,項(xiàng)目管理,超鏈接管理,權(quán)限管理,審計(jì)追蹤;網(wǎng)頁登錄,異地辦公,多人協(xié)同,eCTD文件導(dǎo)入,PDF批量一鍵修復(fù)。同時(shí)提供短期租賃服務(wù),在保證合規(guī)的前提下,為企業(yè)降本增效。 徐匯區(qū)國際注冊(cè)eCTD軟件中ANDA注冊(cè)申報(bào)相關(guān)技術(shù)支持。
法規(guī)文檔管理系統(tǒng) 協(xié)同共享 RDMS可以讓跨區(qū)域、跨部門協(xié)同真正成為1+1>2的 工作。讓頻繁的文檔共享傳輸,版本管理,生命周 期審批都變得輕松簡(jiǎn)單 安全合規(guī) 通過詳細(xì)的審計(jì)追蹤、電子簽名、權(quán)限管理、網(wǎng) 關(guān)控制、頁面控制等技術(shù)手段,構(gòu)建安全合規(guī)的 文檔管理系統(tǒng),通過安全驗(yàn)證與合規(guī)驗(yàn)證 統(tǒng)一文檔來源 藥品注冊(cè)是企業(yè)經(jīng)營成果的技術(shù)資料,由多個(gè)部門 長(zhǎng)時(shí)間匯集到法規(guī)部門。RDMS確保多部門文檔來 源統(tǒng)一,即使人員流動(dòng)也可以快速接續(xù)工作 統(tǒng)一文檔結(jié)構(gòu) 根據(jù)不同申報(bào)類型,自動(dòng)生成文檔結(jié)構(gòu),讓法規(guī) 人員與跨部門同事掌握申報(bào)需要的資料需求,降 低溝通成本,降低經(jīng)驗(yàn)需求,避免疏忽遺漏
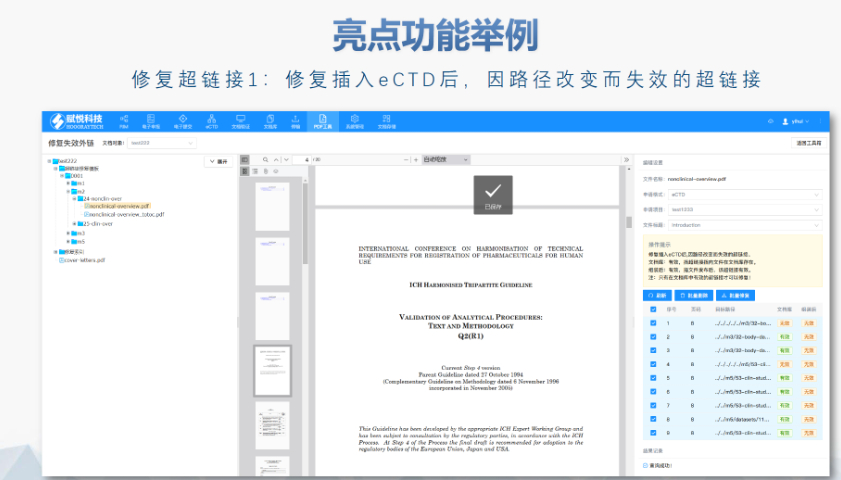
PDF工具箱批量處理與格式修復(fù)支持PDF合并、拆分、提取頁面、旋轉(zhuǎn)頁面等操作,可批量修復(fù)字體未嵌入、超鏈接錯(cuò)誤等問題,確保文件符合注冊(cè)法規(guī)要求。智能書簽與超鏈接管理提供書簽導(dǎo)入/導(dǎo)出、超鏈接自動(dòng)生成(支持關(guān)鍵字搜索鏈接)、題注超鏈接拖拽式編輯等功能,簡(jiǎn)化復(fù)雜文檔的導(dǎo)航設(shè)計(jì)。文檔轉(zhuǎn)換與OCR識(shí)別支持Word轉(zhuǎn)PDF(自動(dòng)生成書簽、嵌入字體),以及PDF與Word、Excel等格式互轉(zhuǎn),集成OCR功能用于掃描件文字識(shí)別。合規(guī)性驗(yàn)證自動(dòng)驗(yàn)證PDF的頁面布局、頁碼連續(xù)性、空白頁、目錄層級(jí)等屬性,并具體錯(cuò)誤位置,減少人工檢查成本。安全與協(xié)作功能支持文檔加密、數(shù)字簽名、云端同步及多設(shè)備共享,滿足企業(yè)級(jí)文件安全管理需求。瑞士eCTD注冊(cè)外包相關(guān)技術(shù)支持。
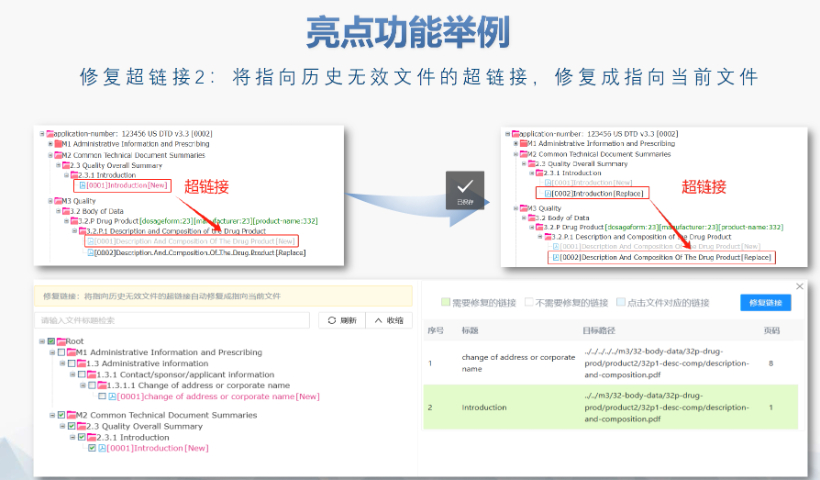
文件生命周期管理:eCTD支持文件替換(Replace)、刪除(Delete)等操作,而非增文件。例如,更臨床研究方案時(shí)需用Replace操作覆蓋舊版本。基線提交(BaselineSubmission)可用于補(bǔ)充歷史紙質(zhì)資料,但需在封面函中聲明無內(nèi)容變更。臨床數(shù)據(jù)與研究標(biāo)簽文件(STF):模塊4和5中的研究數(shù)據(jù)需通過STF(StudyTaggingFiles)引用,確保數(shù)據(jù)與文檔關(guān)聯(lián)。FDA要求數(shù)據(jù)集(如SASXPORT格式)能置于模塊3-5,且單個(gè)文件超過4GB需拆分。2022年統(tǒng)計(jì)顯示,58%的ANDA因研究數(shù)據(jù)技術(shù)拒絕標(biāo)準(zhǔn)(TRC)錯(cuò)誤被拒。電子簽名與表格要求:FDA表格(如356h、1571)需使用數(shù)字簽名,PDF文件禁止加密或設(shè)置編輯限制。電子簽名需符合21CFRPart11規(guī)范,確保身份驗(yàn)證、不可否認(rèn)性和數(shù)據(jù)完整性。外包服務(wù)與系統(tǒng)解決方案:賦悅科技累計(jì)提交超2000份eCTD申請(qǐng),外包可降低40%人工錯(cuò)誤率。歐盟NDA注冊(cè)申報(bào)相關(guān)技術(shù)支持。青海國際注冊(cè)eCTD
瑞士IND注冊(cè)申報(bào)相關(guān)技術(shù)支持。南京中國eCTD系統(tǒng)
美國eCTD驗(yàn)證采用三級(jí)分類:“錯(cuò)誤”(必須修正)、“警告”(建議修正)、“提示信息”(參考)。例如,PDF文件版本不符或加密保護(hù)屬于“錯(cuò)誤”,而書簽路徑非相對(duì)性則可能列為“警告”。驗(yàn)證失敗將直接導(dǎo)致退審,企業(yè)需通過LORENZ Validator等工具預(yù)檢,確保提交前合規(guī)。 ?技術(shù)驗(yàn)證點(diǎn) 驗(yàn)證涵蓋XML結(jié)構(gòu)合規(guī)性、文件命名規(guī)則、生命周期管理(如序列號(hào)連續(xù)性)及PDF屬性(如字體嵌入、可搜索性)。臨床試驗(yàn)數(shù)據(jù)需額外滿足CDISC標(biāo)準(zhǔn),包括SDTM和ADaM數(shù)據(jù)集的結(jié)構(gòu)驗(yàn)證南京中國eCTD系統(tǒng)
- 黑龍江化學(xué)藥品eCTD 2025-07-16
- 工業(yè)園區(qū)化學(xué)藥品eCTD名稱 2025-07-16
- 南京中國eCTD系統(tǒng) 2025-07-16
- 高新區(qū)中國eCTD歡迎選購 2025-05-14
- 靜安區(qū)生物制品eCTD使用 2025-05-14
- 蕪湖新藥eCTD是什么 2025-05-14
- 吳江區(qū)賦悅科技eCTD供應(yīng)商 2025-05-14
- 南京生物制品eCTD注冊(cè)系統(tǒng) 2025-05-14
- 上海化學(xué)藥品eCTD格式 2025-05-09
- 南京電子申報(bào)eCTD哪個(gè)品牌好 2025-05-09
- 淄博個(gè)人短視頻運(yùn)營快速起號(hào)技巧 2025-07-17
- 揭陽安卓設(shè)備usb攝像頭性價(jià)比 2025-07-17
- 重慶機(jī)器人力控定制 2025-07-17
- 貴州數(shù)字會(huì)議系統(tǒng)液晶屏升降器公司 2025-07-17
- 安徽智能控制數(shù)字工廠整體解決方案 2025-07-17
- 上海智慧物業(yè)數(shù)字化生產(chǎn)企業(yè) 2025-07-17
- 浦口區(qū)品牌電商平臺(tái)代運(yùn)營 2025-07-17
- 廈門吊牌打印機(jī)廠家直銷 2025-07-17
- 四川多功能證卡打印機(jī)制造商 2025-07-17
- 寶山區(qū)特色AUTOSAR工具鏈24小時(shí)服務(wù) 2025-07-17